LEY DE GRAHAM.
La Ley de Graham, formulada en 1829 por Thomas Graham, establece que las velocidades de difusión y efusión de los gases son inversamente proporcionales a las raíces cuadradas de sus respectivas masa molares.
Siendo  las velocidades y
las velocidades y  las masas molares.
las masas molares.
Efusión es el flujo de partículas de gas a través de orificios estrechos o poros.
Se hace uso de este principio en el método de efusión de separación de isótopos.
El fenómeno de efusión está relacionado con la energía cinética de las moléculas. Gracias a su movimiento constante, las partículas de una sustancia, se distribuyen uniformemente en el espacio libre. Si hay una concentración mayor de partículas en un punto habrá más choques entre sí, por lo que hará que se muevan hacia las regiones de menor número: las sustancias se efunden de una región de mayor concentración a una región de menor concentración.
De los 4 estados de la materia, los gases presentan la mayor facilidad de difusión de sus respectivas moléculas, como ocurre en el aire, ya que sus moléculas tienen velocidades superiores. Las moléculas de diferentes clases tienen velocidades diferentes, a temperatura constante, dependiendo únicamente de la densidad.
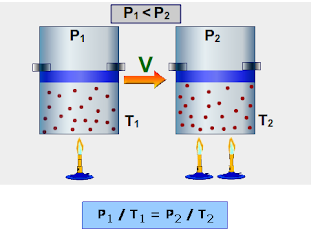
La difusión es el proceso por el cual una sustancia se distribuye uniformemente en el espacio que la encierra o en el medio en que se encuentra. Por ejemplo: si se conectan dos tanques conteniendo el mismo gas a diferentes presiones, en corto tiempo la presión es igual en ambos tanques. También si se introduce una pequeña cantidad de gas A en un extremo de un tanque cerrado que contiene otro gas B, rápidamente el gas A se distribuirá uniformemente por todo el tanque.
La difusión es una consecuencia del movimiento continuo y elástico de las moléculas gaseosas. Gases diferentes tienen distintas velocidades de difusión. Para obtener información cuantitativa sobre las velocidades de difusión se han hecho muchas determinaciones. En una técnica el gas se deja pasar por orificios pequeños a un espacio totalmente vacío; la distribución en estas condiciones se llama efusión y la velocidad de las moléculas es igual que en la difusión. Los resultados son expresados por la ley de Graham. "La velocidad de difusión de un gas es inversamente proporcional a la raíz cuadrada de su densidad."
En donde v1 y v2 son las velocidades de difusión de los gases que se comparan y d1 y d2 son las densidades. Las densidades se pueden relacionar con la masa y el volumen porque (d=m/v ); cuando M sea igual a la masa (peso) v molecular y v al volumen molecular, podemos establecer la siguiente relación entre las velocidades de difusión de dos gases y su peso molecular:
y como los volúmenes moleculares de los gases en condiciones iguales de temperatura y presión son idénticos, es decir V1 = V2, en la ecuación anterior sus raíces cuadradas se cancelan, quedando:
Es decir: la velocidad de difusión de un gas es inversamente proporcional a la raíz cuadrada de su peso molecular.
¿Qué gas tiene mayor velocidad de difusión, el neón o el nitrógeno?
Primero se necesita conocer las densidades de los gases que intervienen. Como un mol de gas ocupa 22,4 L a T.P.E., sus densidades serán (peso molecular/volumen).
neón = 20/22,4 = 0,88 g/l
nitrógeno = 28/22,4 = 1,25 g/l
sea v1 = velocidad de difusión del nitrógeno y v2 = velocidad de difusión del neón.
Debido a que la velocidad de difusión es inversamente proporcional a las densidades, tendrá mayor velocidad de difusión el menos denso.
¿Cuál es la velocidad de efusión del oxígeno con respecto al hidrógeno?
Si la masa molar del oxígeno es 32 y la del hidrógeno es 2 (gases diatómicos):
La velocidad de efusión del hidrógeno es 4 veces mayor que la del oxígeno.